Énergie libérée lors de la combustion d'un hydrocarbure ou d'un alcool

I Définition de l'énergie chimique
-L'énergie chimique est un réservoir d'énergie
-On peut libérer cette énergie lors d'une réaction chimique
➥Rupture/formation de liaison covalente = libération d'énergie
On peut convertir l'énergie chimique en:
-Énergie thermique et rayonnante (chaleur,flamme...)
-Énergie électrique (pile batterie...)
-Énergie mécanique (muscles...)
REMARQUE: pétrole,gaz naturel,biomasse.. sont des réservoirs d'énergie chimique que l'on récupère majoritairement par combustion
II Équation d'une combustion
-Respect des règles de conservation des éléments chimique
-Combustion complète d'une espèce organique -> création de CO2 et H2O
Exemple, combustion du butane: 2 C4H10 + 13 O2 -> 8 CO2 + 10 H2O
-Combustion incomplète = manque de O2 -> création de C (poudre noir) et CO (gaz toxique)
➥On écrit alors l'équation de la combustion pour chaque espèce de carbone formée
III Ordre de grandeur de l'énergie libérée lors d'une combustion
-Une combustion crée de l'énergie thermique
-Énergie de combustion = énergie donnée par kilo de combustible (boisnessence...) brûlé
➥ Exprimé en kJ.kg-1 alors aussi appelé pouvoir calorifique ℘ du combustible
➥ ou exprimé en kJ.L-1 pour les liquide/gaz, en J.mol-1 pour les espèces chimique
-Les énergies thermiques molaires de combustion sont 100 à 1000 fois plus grande que celles de changements d'état
➥A cause de la nature des liaisons qui se rompent
-Van der Waals ou hydrogène pendant un changement d'état
-Liaisons covalente pendant une réaction chimique
IV Chauffage d'un corps
1) Transfert thermique avec variation de température
-Tout les corps ne sont pas aussi faciles à chauffer
➥ Cela dépend de la caractéristique thermique massique du corps
FORMULE
-Énergie E à transmettre à un corps pour élever de Δθ sa température:
- E = m ✕ c ✕ (θfinal-θinitial)
REMARQUE: on peut avoir la forme: E = m ✕ c ✕ Δθ
E: énergie thermique transférée en J
m: masse en Kg
θ: température en °C, Δθ: différences de température en °C
c: capacité thermique massique en J.Kg-1.°C-1
2) Changement d'état et transfert thermique
Le transfert d'énergie thermique à énergie chimique peut:
-Créer une variation de température
-Créer un changement d'état
A pression constante, le passage solide-liquide et liquide-gaz s'effectue à température constante
FORMULE:
Énergie thermique E transférée lors d'un changement d'état:
- E = m ✕ L
E: énergie thermique transférée lors du changement d'état en Joule
m: masse en kg
L: énergie massique de changement d'état en J.kg-1 (= chaleur latente)
V Impact des combustions
Consommation d'énergie primaire:
➥Épuisement des ressources
➥Pollution de l'air
➥Émission de CO2 -> Effet de serre
VI L'essentiel
Transfert thermique lors d'une combustion
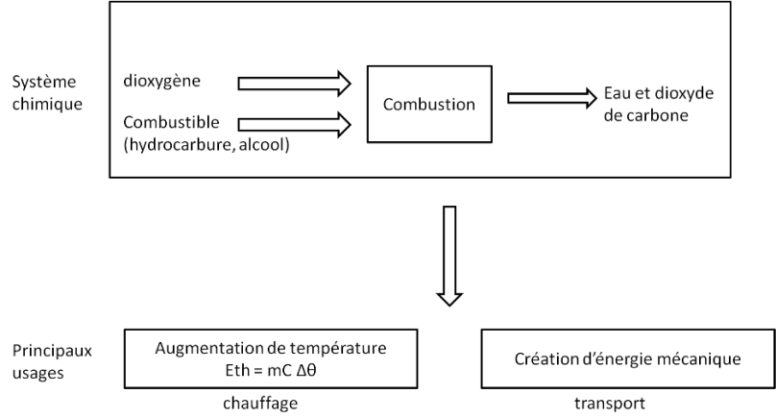
Formules:
Eth = m ✕ Ecombustion massique
➥m: masse
Eth = n ✕ Ecombustion molaire
➥n: nombrede moles
Eth: énergie transférée à l'environnement pendant une combustion (J)
Ecombustion molaire: énergie de combustion du combustible utilisé (J.mol-1)
Ecombustion massique: énergie de combustion du combustible utilisé (J.g-1)
C: capacité calorifique du corps chauffé (J.g-1.°C-1)
Δθ: variation de la température du corps chauffé (°C)
-
Partagez ce cours !
Suivez Nicolas KRITTER sur google + ( cours inspiré de celui fait par le professeur de la classe)
